L’approvvigionamento di medicamenti in Svizzera non può essere assicurato in tutti i casi e, malgrado le misure adottate, la situazione rimane tesa. La Confederazione intende rafforzare l’approvvigionamento di medicamenti attuando ulteriori misure.
Le difficoltà di approvvigionamento di medicamenti, in aumento in tutto il mondo, interessano anche la Svizzera. La situazione rimane tesa e ciò si manifesta nelle notifiche del centro di notifica per i medicamenti a uso umano d’importanza vitale dell’approvvigionamento economico del Paese (AEP).
Le difficoltà riguardano prevalentemente i generici e i medicamenti con brevetto scaduto, in particolare gli antidolorifici forti (come gli oppioidi), i vaccini, l’insulina e gli antibiotici. I pazienti interessati sono pertanto numerosi.
Le cause delle difficoltà nell’approvvigionamento di medicamenti
Le cause e le conseguenze di queste difficoltà sono complesse. Hanno origini perlopiù globali e si sono evolute nel corso dei decenni. Ad acuire le difficoltà di approvvigionamento possono concorrere anche alcune specificità della Svizzera. Le cause e le conseguenze possono essere riassunte come segue:
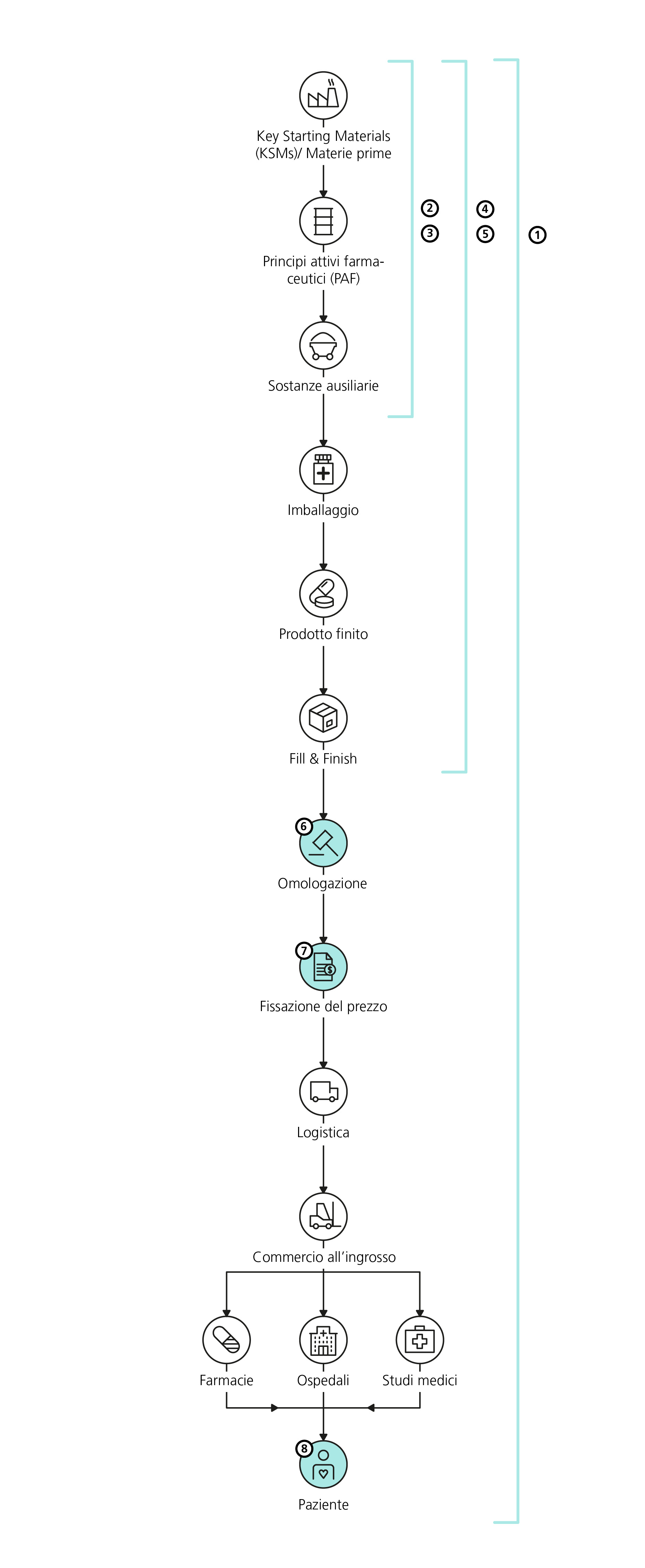
1 La pressione economica, la politica di sovvenzionamento e normative meno severe nei Paesi a basso reddito hanno condotto alla globalizzazione del settore farmaceutico.
2 Segmenti importanti delle catene di creazione del valore, tra cui la produzione di principi attivi essenziali, sono stati dislocati in Asia (p. es. in Cina e in India).
3 La concentrazione su poche aziende offerenti e la dipendenza reciproca che ne consegue si sono notevolmente rafforzate. Per esempio, circa un terzo dei principi attivi utilizzati nel mercato dei medicamenti generici statunitense è prodotto da una sola azienda e un altro terzo da due o al massimo tre aziende.
4 I moderni concetti di produzione e supply chain, come la produzione e fornitura «just-in-time», hanno causato una diminuzione delle riserve lungo l’intera catena di creazione del valore. La produzione e fornitura «just-in-time» è un modo di produrre sincronizzato con la domanda, nel quale i materiali vengono forniti nella quantità e nel momento esatti in cui sono necessari per la produzione. Forti aumenti della domanda non possono dunque essere soddisfatti a causa di riserve di produzione limitate.
5 I rischi di concentrazione delle catene di fornitura globali aumentano e così si riduce la resilienza delle catene di fornitura di fronte a fattori esterni, tra cui conflitti geopolitici, restrizioni all’esportazione, catastrofi naturali, pandemie e picchi di domanda.
6 Per poter immettere un medicamento sul mercato svizzero, i fabbricanti devono farlo omologare secondo le prescrizioni svizzere.
7 Per l’industria farmaceutica che opera su scala globale, il mercato svizzero è economicamente poco interessante nel confronto internazionale, viste le sue piccole dimensioni.
8 A causa dei fattori menzionati, il mercato non è in grado di reagire in modo adeguato. Farmacie e farmacie ospedaliere fabbricano medicamenti per i pazienti, vengono applicate deroghe sancite a livello di legge come l’immissione in commercio limitata di medicamenti non omologati in Svizzera e i pazienti ricevono terapie sostitutive.
Che cosa ha fatto finora la Confederazione
Il compito di assicurare l’approvvigionamento di medicamenti in Svizzera non spetta soltanto alla Confederazione, ma principalmente all’economia (art. 102 Cost. nonché art. 3 cpv. 1 LAP). In linea di principio, i Cantoni sono responsabili del settore sanitario sul loro territorio (competenza sussidiaria generale dei Cantoni; art. 3 e art. 42 cpv. 1 Cost.). La Confederazione assume un compito di approvvigionamento sussidiario soltanto in caso di gravi situazioni di penuria (art. 102 Cost. in combinato disposto con la LAP) o di una pandemia, quando mancano beni e servizi di importanza vitale o i più importanti agenti terapeutici per lottare contro le malattie trasmissibili (art. 118 cpv. 2 lett. b Cost. nonché art. 44 LEp).
Nella situazione attuale non sussiste tuttavia tale presupposto costituzionale. Il margine di manovra della Confederazione è dunque limitato, ma essa ricopre un ruolo di coordinamento e cerca soluzioni.

2006 Il Consiglio federale adotta per la prima volta misure volte a migliorare la sicurezza dell’approvvigionamento.
2009 La prima tappa della revisione della legge sugli agenti terapeutici (LATer; RS 812.21) crea le basi legali affinché gli ospedali possano fornire ai loro pazienti migliori garanzie in materia di medicamenti.
2012 Un intervento parlamentare (postulato Heim 12.3426) incarica il Consiglio federale di analizzare la situazione dell’approvvigionamento in Svizzera.
2015 Il centro di notifica per i medicamenti a uso umano d’importanza vitale facente capo all’AEP entra in funzione.
2016 Nel suo rapporto in adempimento del postulato Heim 12.3426 «Assicurare l’approvvigionamento di medicamenti», il Consiglio federale propone misure strutturali e procedurali per la Confederazione e i Cantoni, al fine di migliorare in modo efficace e duraturo l’approvvigionamento sicuro e ordinato di medicamenti.
2019 Le modifiche proposte nell’ambito del postulato Heim entrano in vigore nel 2019, con la seconda tappa della revisione della LATer, e permettono al Consiglio federale di adottare nuovamente misure per ampliare il margine di manovra dei fornitori di prestazioni al fine di rafforzare la garanzia di approvvigionamento dei pazienti. Tra queste figurano anche alcune agevolazioni per la fabbricazione in proprio nonché l’immissione in commercio limitata di medicamenti non omologati in Svizzera.
2019 Per integrare costantemente le misure finora adottate, l’UFSP, in collaborazione con il settore Agenti terapeutici dell’AEP, Swissmedic e la Farmacia dell’esercito, è incaricato di analizzare nuovamente la sicurezza dell’approvvigionamento in Svizzera e di proporre ulteriori misure.
2022 Il 16 febbraio, il Consiglio federale prende atto del rapporto «Difficoltà di approvvigionamento di medicamenti per uso umano in Svizzera: analisi della situazione e misure di miglioramento da esaminare».
2022 Con la pubblicazione del rapporto sull’approvvigionamento, il Dipartimento federale dell’interno (DFI; UFSP) e il Dipartimento federale dell’economia, della formazione e della ricerca (DEFR; AEP) sono incaricati, in collaborazione con il Dipartimento federale della difesa, della protezione della popolazione e dello sport (DDPS; in particolare la Farmacia dell’esercito) e con il coinvolgimento di portatori di interessi del settore sanitario rilevanti, di esaminare in maniera approfondita le misure che vi sono elencate e di elaborare proposte di attuazione concrete.
2023 Le prime proposte di attuazione vengono presentate al Consiglio federale. Su proposta del settore Agenti terapeutici dell’AEP, il Consiglio federale decide di ampliare l’obbligo di notifica e di verificare la possibilità di espandere la piattaforma di notifica.
2024 L’AEP presenta al Consiglio federale diverse varianti di espansione. In gennaio, il Consiglio federale incarica il DEFR di istituire una piattaforma di monitoraggio degli agenti terapeutici efficiente e orientata al futuro.
2024 In agosto, il Consiglio federale prende atto del rapporto finale del 2024 «Proposte di attuazione delle misure contenute nel rapporto dell’UFSP sulle difficoltà di approvvigionamento di medicamenti: rapporto finale del gruppo di lavoro interdisciplinare». Quest’ultimo contiene i risultati dell’analisi e lun ulteriore pacchetto di proposte di attuazione per migliorare la situazione dell’approvvigionamento di medicamenti in Svizzera. Il Consiglio federale conferisce mandati di attuazione al DFI, al DEFR e al DDPS. Si tratta di misure strutturali che possono aumentare la resilienza del sistema di fronte ai problemi di approvvigionamento.
Il Consiglio federale conferisce inoltre al DFI il mandato di istituire un ulteriore gruppo di esperti per la sicurezza dell’approvvigionamento. In questo modo vuole tenere conto dello sviluppo dinamico relativo all’approvvigionamento di medicamenti.
2025 Il gruppo di esperti viene istituito e inizia il suo lavoro. I risultati ed eventuali altre proposte di attuazione devono essere presentati al Consiglio federale alla fine del 2025.
Contemporaneamente vengono avviati i primi lavori di attuazione per rafforzare la sicurezza dell’approvvigionamento. Swissmedic esamina ulteriori facilitazioni per quanto riguarda l’omologazione con procedura semplificata. I risultati devono essere presentati al Consiglio federale alla fine del 2025 e si deve decidere come procedere.
Nell’ambito della revisione 3b della legge sugli agenti terapeutici in atto devono essere proposte modifiche nei settori della fabbricazione in proprio da parte della Confederazione e dell’immissione in commercio limitata, in quanto a durata e quantità, di medicamenti non omologati in Svizzera. L’avvio della consultazione è previsto nel quarto trimestre del 2025.
Per superare le gravi situazioni di carenza di medicamenti, i farmacisti cantonali svizzeri (AFC), insieme all’UFSP e a Swissmedic, hanno concordato di adottare temporaneamente un’interpretazione più ampia del concetto di «casi urgenti» previsto dall’articolo 49 dell’ordinanza sull’autorizzazione dei medicamenti (OAMed). È dunque possibile importare e conservare per un breve periodo medicamenti non omologati o non disponibili in Svizzera che servono con urgenza anche qualora non siano destinati a un determinato paziente. La nuova disposizione costituisce una soluzione transitoria applicabile fino all’entrata in vigore delle modifiche giuridiche attualmente in corso nell’ambito della revisione 3b della legge sugli agenti terapeutici. Essa migliora l’approvvigionamento soprattutto nel settore pediatrico, in quanto i medicamenti adatti ai bambini sono più spesso soggetti a carenze di approvvigionamento sia per fattori economici sia per la mancanza di alternative. Tale misura consente di rispondere in modo rapido e conforme alla legge a bisogni particolarmente urgenti, evitando che i bambini malati debbano attendere per ricevere i medicamenti necessari.
Domande frequenti (FAQ)
Ulteriori informazioni e FAQ sono disponibili qui:
Domande frequenti (FAQ) sull’approvvigionamento di medicamenti
Ultima modifica 10.06.2025
Contatto
Ufficio federale della sanità pubblica UFSP
Direzione Protezione della Salute
Centro di competenza per la sicurezza dell’approvvigionamento
Schwarzenburgstrasse 157
3003
Berna
Svizzera

